肝细胞癌(Hepatocellular carcinoma,HCC)是全球范围内最常见的恶性肿瘤之一,其高发病率和高死亡率严重威胁着人类健康。现有靶向药物如索拉非尼(sorafenib)及免疫检查点抑制剂疗效有限,患者普遍存在原发性耐药,导致预后不佳。代谢重编程是肿瘤能量供应的核心驱动力,为肿瘤靶向治疗提供了独特视角。这一过程不仅重塑肿瘤细胞的代谢网络,还通过代谢物信号传导及代谢酶的非经典活性(如RNA结合功能)调控RNA代谢,从而实现对基因表达的多层级精准调控。然而,代谢酶作为RNA结合蛋白(RBP)在调控转录后水平直接调控肝癌进展中的机制尚不明确。病毒性肝炎研究所、感染性疾病分子生物学教育部重点实验室黄爱龙、唐霓教授团队在国际权威期刊Signal Transduction and Targeted Therapy发表题为“Phosphoglycerate dehydrogenase stabilizes protein kinase C delta type mRNA to promote hepatocellular carcinoma progression”的研究论文。该研究首次揭示丝氨酸合成代谢关键酶PHGDH作为RNA结合蛋白的全新功能,并创新性开发靶向PHGDH RNA结合活性的"诱饵寡核苷酸"联合疗法,为肝癌靶向治疗提供了新策略。

研究团队运用RNA-蛋白质互作组捕获技术,首次在肝癌细胞中系统性筛选了RNA结合蛋白。通过对500余个mRNA结合蛋白的分析,该团队突破性地鉴定出丝氨酸合成代谢关键酶PHGDH具有RNA结合能力(该酶虽在多种肿瘤恶性进展中发挥重要作用,但其RNA结合功能此前未见报道)。团队通过生物信息学预测结合实验验证,首次鉴定PHGDH的125-166氨基酸区域为其功能性RNA结合结构域(RBD)----这是该酶中全新发现的RNA结合结构域,缺失该区域显著抑制了PHGDH对肝癌细胞的促增殖作用。进一步通过RIP-seq高通量筛选发现,PHGDH结合的下游靶基因显著富集于自噬及线粒体自噬通路。联合RIP-qPCR、RNA pull-down和RNA荧光原位杂交等技术证实:PHGDH通过其RBD特异性识别PRKCD mRNA的3'-UTR特定基序"AGUGGAA",显著增强其mRNA稳定性,最终上调PRKCD蛋白表达。PRKCD是线粒体自噬的正向调节因子,PHGDH通过PRKCD招募ULK1复合体触发线粒体自噬,清除受损线粒体并抑制凋亡,从而驱动肝癌进展。该研究首次阐明代谢酶PHGDH通过RNA结合功能直接调控线粒体自噬的分子机制。
基于上述机制,研究团队设计了特异性靶向PHGDH RBP功能的诱饵寡核苷酸(Decoy Oligonucleotides)。该诱饵寡核苷酸能有效阻断PHGDH与PRKCD mRNA的结合,从而减弱PHGDH对PRKCDmRNA的稳定作用,最终通过调节线粒体自噬而抑制肝癌进展。此外,在多种肝癌动物模型中,诱饵寡核苷酸单独给药即能有效抑制肝癌肿瘤进展;联合索拉非尼或PRKCD抑制剂索曲妥林(sotrastaurin)更展现出显著的协同抗肿瘤作用,为肝癌的靶向治疗提供了一种全新的策略。
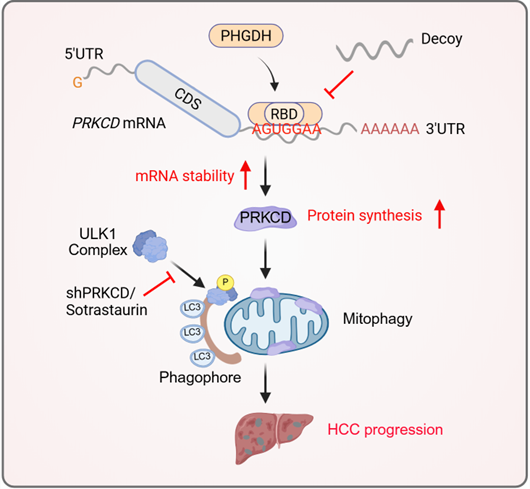
该研究首次将代谢重编程、RNA调控与线粒体自噬有机整合,通过解析代谢酶PHGDH的RBP功能调控RNA代谢的新机制,揭示了肝癌发生发展的关键通路,拓展了对代谢酶非经典功能的认识。基于该机制设计的靶向PHGDH-RNA结合的诱饵寡核苷酸,联合现有临床药物(sorafenib/sotrastaurin)可协同抑制肝癌肿瘤进展,为肝癌靶向治疗提供了靶向RNA-蛋白质互作的新路径。
程彬博士后、彭湃副研究员、陈诗博士为论文共同第一作者,黄爱龙教授、唐霓教授、汪凯研究员为共同通讯作者。该研究受到国家重点研发计划、国家自然科学基金、重庆英才计划及重庆医科大学未来医学青年创新团队等项目资助。
原文链接:https://doi.org/10.1038/s41392-025-02304-w
宽仁科研--文章分享
